新闻网讯 脑胶质瘤(Glioblastoma,GBM)是一种高度侵袭性的脑肿瘤,临床预后极差,其恶性进展主要受胶质母细胞瘤干细胞(GSCs)驱动。GSCs通过自我更新及重塑肿瘤微环境,持续推动肿瘤生长与演进。为适应高能量需求、维持干性状态并抵抗放化疗,GSCs能够重编程自身代谢途径。在这一代谢网络中,乳酸不仅作为能量底物,还充当信号分子并通过乳酰化修饰蛋白质,从而协同促进肿瘤进展。然而,GSCs如何感知并响应微环境中的乳酸信号,以及乳酸的主要细胞来源,此前尚未完全阐明。
2026年1月,我校肿瘤研究院任贺教授、马蕾娜副教授与蒋孝明博士等合作,在《自然·细胞生物学》(Nature Cell Biology,影响因子19.17)发表了题为“Immune Evasion by Macrophage-derived Lactate”的评述文章。
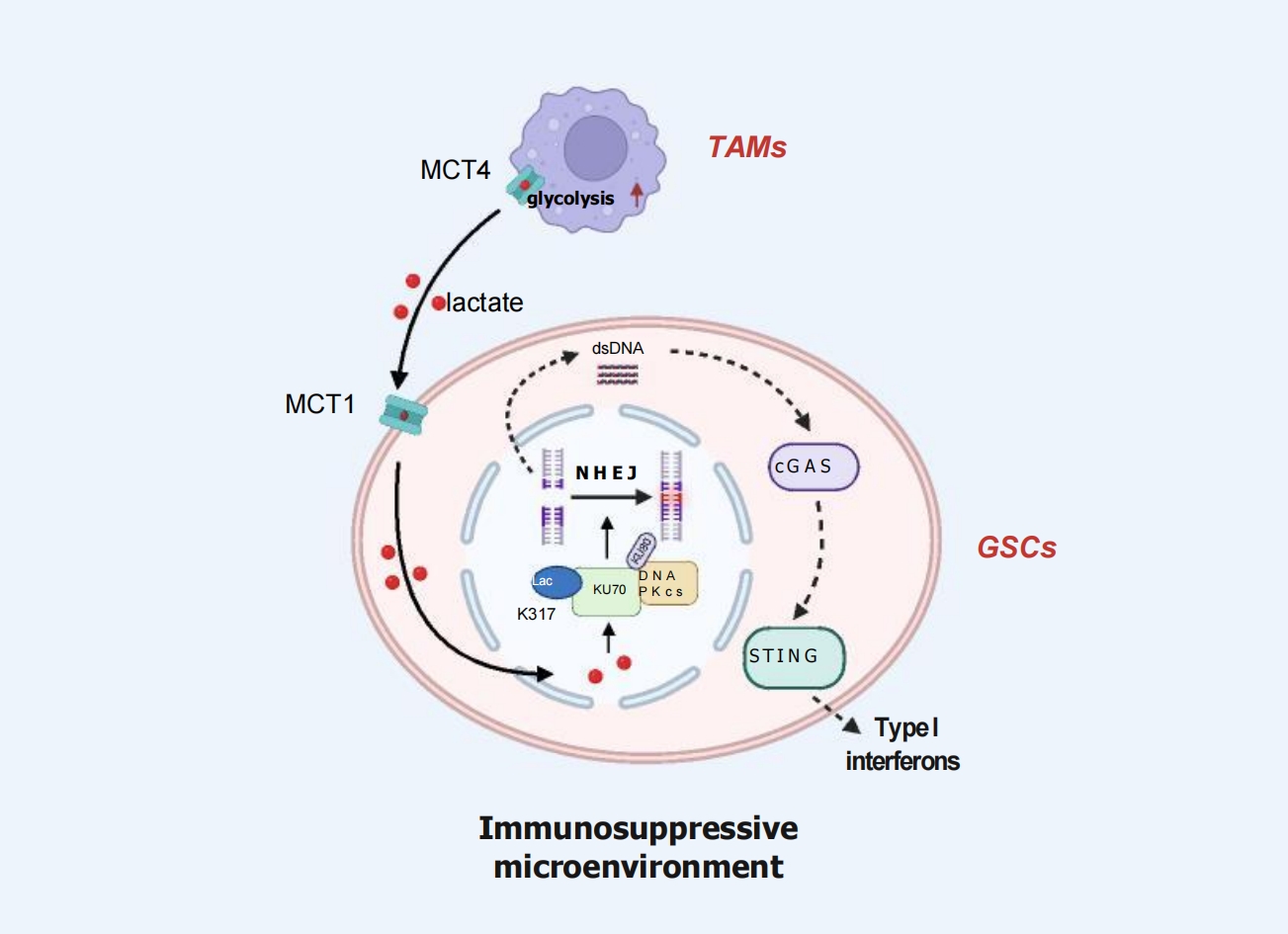
图1从TAMs到GSCs的乳酸穿梭驱动了DNA修复和免疫逃逸
该文对南京医科大学张军霞教授、汪秀星教授团队同期发表于该期刊的研究论文“Inhibition of macrophage-derived lactate impairs KU70 lactylation and enhances anti-tumour immunity in glioblastoma”进行了系统述评。该研究揭示,在GBM中,肿瘤相关巨噬细胞(TAMs)通过单羧酸转运蛋白MCT4分泌乳酸,而GSCs则通过MCT1摄取乳酸,进而诱发KU70蛋白第317位赖氨酸发生乳酰化修饰。这一修饰增强GSCs的非同源末端连接DNA修复能力,同时抑制cGAS-STING-I型干扰素信号通路,从而促进免疫抑制微环境形成并驱动肿瘤进展(图1)。进一步实验表明,抑制乳酸转运(如使用MCT1/4抑制剂)或靶向KU70 K317乳酰化位点,联合PD-1免疫检查点抑制剂阻断,可显著增强CD8+ T细胞的抗肿瘤活性。

本评述指出,该研究深化了对乳酸在肿瘤微环境中多重功能的理解——乳酸不仅是代谢中间产物,更是连接代谢重编程与免疫逃逸的关键信号分子和翻译后修饰调控因子。这一发现为GBM的联合免疫治疗提供了新的代谢干预思路与潜在靶点。





![]() 鲁公网安备 37021202000856号
鲁公网安备 37021202000856号 ![]()